medi.ru »» Периодика »» Вопросы медицинской химии »» № 4 '99
УДК 615.849.19
©Коллектив авторов
АНТИОКСИДАНТНЫЕ СВОЙСТВА АРБИДОЛА И ЕГО СТРУКТУРНЫХ АНАЛОГОВ
ВАСИЛЬЕВА О.В., ЛЮБИЦКИЙ О.Б.1, ГУСЬКОВА Т.А.2, ГЛУШКОВ Р.Г.2, МЕДВЕДЕВ О.С., ВЛАДИМИРОВ Ю.А1
Факультет фундаментальной медицины Московского государственного университета им.М.В.Ломоносова, 119899, Москва, МГУ, Корпус А, к. 1029, факс:(095)143-26-64; электронная почта:medfac@fbm.msu.ru;
1Кафедра биофизики Российского государственного медицинского университета, 117869, Москва, ул. Островитянова, д. 1, факс:(095)246-46-30; электронная почта: yuvlad@mail.ru;
2Центр по химии лекарственных средств (ЦХЛС - ВНИХФИ), 119815, Москва, Зубовская улица, д. 7, тел. 246-45-41.
Изучено влияние арбидола и его структурных аналогов на процесс перекисного окисления фосфолипидных липосом, индуцированного ионами двухвалентного железа. Показано, что антиоксидантная активность арбидола и его производных на два-три порядка меньше, чем у ?-токоферола. Предполагается, что механизм антиоксидантного действия арбидола и его структурных аналогов заключается в перехвате липидных радикалов, а не хелатировании Fe2+.
Ключевые слова: пероксидное окисление липидов, арбидол, антиоксиданты, хемилюминесценция.
ВВЕДЕНИЕ. Хорошо известно, что развитие целого ряда патологических состояний организма человека сопровождается активацией процесса свободнорадикального перекисного окисления липидов (ПОЛ) [1-6]. Для лечения заболеваний, протекающих на фоне синдрома липидной пероксидации широко используются природные и синтетические антиоксиданты (АО), такие как альфа-токоферол, каротиноиды, пробукол и другие [7]. Однако антиоксидантные свойства могут проявляться и у различных фармакологических препаратов помимо основного механизма их действия. Эти свойства обнаружены у противовоспалительных средств [8], спазмолитиков [9], антисептиков, противогистаминных и противовирусных препаратов [10]. Изучению антиоксидантных свойств противовирусных препаратов уделяется особое внимание в связи тем, что инфицирование вирусами во многих случаях сопровождается развитием воспалительного процесса в тканях, вследствии чего усиливается процесс ПОЛ [10]. Поэтому, наличие антиоксидантных свойств у противовирусного препарата является важным фактором в механизме профилактического и терапевтического действия этого вещества.
В связи с этим большой интерес представляет высокоэффективный противовирусный препарат арбидол [10]. Арбидол обладает антиканцерогенными и радиопротекторными свойствами, является иммуномодулятором [11] и индуктором интерферона [12]. Помимо этого, имеются данные об антиоксидантных свойствах арбидола. Глушковым с соавт. [13] было исследовано влияние арбидола на интенсивность хемилюминесценции (ХЛ), сопровождающей окисление суспензии липопротеинов яичного желтка. Показано, что интенсивность ХЛ снижалась на 50% при концентрации арбидола равной 0,9?10-5 М, что в 100 раз ниже, чем у эмоксипина. Следовательно, арбидол угнетает интенсивность процессов ПОЛ в большей степени, чем известный АО эмоксипин. Однако, как указывают сами авторы, конкретный механизм торможения арбидолом окисления желточных липопротеинов установить окончательно не представлялось возможным в связи с тем, что снижение интенсивности ХЛ в данной модельной системе может определяться как взаимодействием препарата со свободными радикалами, так и хелатированием и/или окислением двухвалентного железа.
Для того, чтобы изучить конкретный механизм действия арбидола на процесс ПОЛ, нами было исследовано его влияние на ХЛ, сопровождающую окисление трис-буферной суспензии фосфолипидных (ФЛ) липосом (ЛС), индуцированное ионами двухвалентного железа [14]. Кинетика ХЛ в данной системе разделена на четко выраженные стадии: быстрая вспышка ХЛ, латентный период и медленная вспышка ХЛ. Применение трис-буфера позволяет хорошо отличить медленную вспышку ХЛ, которая непосредственно отражает окисление в липидной фазе мембран, от стационарного свечения в водной фазе, наблюдающегося при окислении в фосфатном буфере [13]. Кроме того, по изменению латентного периода можно судить о влиянии исследуемого вещества на концентрацию ионов железа.
В связи с этим целью настоящей работы было изучение влияния арбидола, а также его структурных аналогов на кинетику ХЛ, сопровождающей окисление суспензии фосфолипидных липосом, индуцированное ионами двухвалентного железа.
МЕТОДИКА. В работе использовали альфа-токоферол (“Serva”, Германия), аскорбат, ЭДТА (“Sigma”, США), арбидол (этиловый эфир 1-метил-2-фенилтиометил-4-диметиламинометил-5-окси-6-броминдол-3 карбоновой кислоты гидрохлорид моногидрат) и его структурные аналоги, производные 5-оксииндола - СП-224, СП-226 и СП-234. Арбидол создан в Центре по химии лекарственных средств Москвы (ЦХЛС-ВНИХФИ) при участии Института медицинской радиологии Обнинска и НИИЭМ им. Пастера Санкт-Петербурга. Структурные аналоги арбидола были любезно предоставлены руководителем отдела экспериментальной химиотерапии и токсикологии Центра по химии лекарственных средств член-корр. РАМН Т.А. Гуськовой.
Для получения липосом выделяли фосфолипиды из желтков куриных яиц по методу Folch et al. [15] с последующей очисткой от нейтральных липидов и пигментов в охлажденном обезвоженном ацетоне [16]. Концентрацию ФЛ в липидных экстрактах определяли гравиметрически. Суспензию ЛС готовили по методу Вangham et al. [17]. Для этого хлороформ-метанольный раствор ФЛ выпаривали на вакуумном роторном испарителе. К полученной сухой липидной пленке добавляли буферный раствор (20 мМ трис-НCl, рН 7.4) и образовавшуюся суспензию многократно перемораживали.
Измерение ХЛ осуществляли на хемилюминометре ХЛМ-3 (“БИКАП”, Россия). Кинетика ХЛ обрабатывалась с помощью системы Macintosh LC II - MacLab/2e (ADInstruments, Австралия). Все эксперименты проводились при температуре 37ОC и постоянном перемешивании. Реакционная среда содержала суспензию ЛС (0,4 мг/мл ФЛ), 0,1 мкМ акти-ватора хемилюминесценции С-525 [18] в 20 мМ трис-HCl буфере, рН 7,4. Инициирование липидной пероксидации осуществляли введением 7 мкМ раствора FeSO4 в 0,001 N HСl. Арбидол, альфа-токоферол, СП-226 и СП-224 растворяли в хлороформе и добавляли к хлороформ-метанольному раствору ФЛ перед формированием ЛС. ЭДТА, аскорбат и СП-234 добавляли к суспензии фосфолипидных липосом в виде раствора в трис-НСl буфере перед введением раствора железа.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ. Кинетика ХЛ, сопровождающая окисление суспензии фосфолипидных ЛС (рис. 1) включает в себя быструю вспышку ХЛ, развивающуюся непосредственно после введения ионов двухвалентного железа, стадию угнетения свечения и медленную вспышку ХЛ. Как было показано ранее [14], амплитуда медленной вспышки ХЛ (Io) и время от момента введения ионов железа до максимума интенсивности медленной вспышки ХЛ (латентный период ХЛ (To) являются оптимальными параметрами, характеризующими протекание процесса ПОЛ в суспензии ЛС. На рис. 1 показано влияние арбидола на кинетику ХЛ суспензии ФЛ липосом. Видно, что с увеличением его концентрации (цифры у кривых) происходит уменьшение амплитуды (I) и увеличение латентного периода (T) ХЛ.
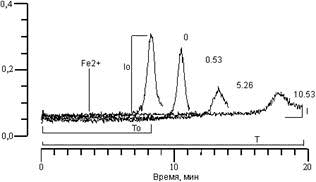
Рисунок 1.
Влияние арбидола на кинетику ХЛ, сопровождающей Fe2+-индуцированное окисление суспензии фосфолипидных ЛС. Цифры у кривых - концентрация арбидола в мкМ. По оси абсцисс - время (мин). По оси ординат - интенсивность ХЛ (отн.ед.). Состав реакционной среды: суспензия ЛС (0,4 мг фосфолипидов на 1 мл), 0,1 мкМ С-525, 7 мкМ FeSO4 в 20 мМ трис-HCl буфере, рН 7,4. Момент введения ионов железа показан стрелкой.
Добавление к суспензии различных концентраций СП-224, СП-226 и СП-234 приводило к аналогичным изменениям кинетики ХЛ. На рис. 2 , а показано влияние арбидола и его структурных аналогов на изменение амплитуды ХЛ (I/Io). Видно, что с увеличением концентрации всех веществ происходит уменьшение амплитуды ХЛ. Концентрация 50%-го ингибирования амплитуды ХЛ (С50%) может в данном случае служить мерой способности данного соединения тормозить процесс ПОЛ. На рис. 2, б показано влияние вышеперечисленных веществ на изменение латентного периода ХЛ. Видно, что с увеличением концентрации этих веществ происходит увеличение латентного периода ХЛ. Как было показано ранее [14], при добавлении различных соединений к суспензии липосом латентный период ХЛ может уменьшаться, либо оставаться без изменения или увеличиваться. Уменьшение латентного периода ХЛ происходит при комплексировании исследуемого вещества с ионами Fe2+, которые при этом выпадают из реакций цепного окисления в липидной фазе. В случае арбидола и его аналогов происходит увеличение латентного периода ХЛ, поэтому ингибирование процесса ПОЛ происходит не за счет взаимодействия с ионами железа.
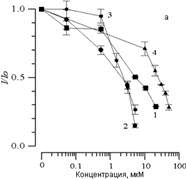
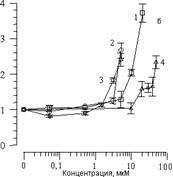
Рисунок 2.
Влияние арбидола (1), СП 224 (2), СП 226 (3) и СП 234 (4) на изменение амплитуды (а) и латентного периода (б) ХЛ, сопровождающей Fe2+-индуцированное окисление суспензии фосфолипидных ЛС. По оси абсцисс - концентрация добавленного вещества (мкМ). По оси ординат - изменение параметров ХЛ (отн. ед.). Состав реакционной среды, как на рис. 1.
В таблице суммированы полученные данные о влиянии арбидола, его структурных аналогов и других АО на окисление суспензии ФЛ липосом. Значение С50% для арбидола составила 5 мкМ, что в два раза больше, чем для СП-224 и СП-226 и в 5,5 раз меньше, чем для СП-234. Сравнение полученных значений для арбидола и его структурных аналогов с аналогичными значениями для некоторых других АО показало, что они на два-три порядка больше, чем для альфа-токоферола и приблизительно схожи с данными для аскорбата. Таким образом, в нашей системе арбидол и его производные менее эффективны в качестве антиоксидантов, чем альфа-токоферол и близки к аскорбату. Отчасти это может быть связано с меньшей, по сравнению с альфа-токоферолом, растворимостью арбидола в липидной фазе. Интересно, что увеличение латентного периода ХЛ для арбидола и его структурных аналогов в этих условиях одинаково и равно в среднем 1,5 (см. таблицу). Это в три раза меньше, чем для альфа-токоферола и в 6 раз меньше, чем для аскорбата. Важно, однако, что добавление всех этих веществ к суспензии ФЛ липосом приводит к увеличению латентного периода ХЛ, в то время как ЭДТА, связывающий ионы железа, его уменьшает. Как видно из таблицы, уменьшение латентного периода в два раза происходит при концентрации ЭДТА 1,4 мкМ.
Таблица. Влияние арбидола, его структурных аналогов и других антиоксидантов на окисление суспензии фосфолипидных ЛС.
Вещество С, мкМ I/Io T/To
альфа-токоферол 0.06 0.5 4.2
СП-226 2.4 0.5 1.5
СП-224 2.6 0.5 1.3
Арбидол 5 0.5 1.3
Аскорбат 14 0.5 9.0
СП-234 27.5 0.5 1.7
ЭДТА 1.4 0.8 0.5
Таким образом, показано, что арбидол и его структурные аналоги ингибируют окисление суспензии фосфолипидных ЛС, индуцированное ионами Fe2+. Это действие не связано с хелатированием ионов Fe2+, так как латентный период ХЛ не уменьшался, как в случае с типичными хелаторами ионов Fe2+ (например, ЭДТА), а увеличивался. Можно предположить, что арбидол и его структурные аналоги являются перехватчиками пероксидных радикалов, образующихся в системе. При этом эффективность арбидола и его структурных аналогов приблизительно одинакова.
ЛИТЕРАТУРА
1. Vladimirov Y.A. (1986). Free Radicals, Aging and Degenerative Diseases. N. Y., London, Alan R. Liss Inc., 141-195.
2. Владимиров Ю. А., Арчаков А.И. (1972). Перекисное окисление липидов в биологических мембранах. М., Наука.
3. Halliwell B., Gutteridge J.M.C. (1990). Arch. Biochem. Biophys., 280, 1-8.
4. Бурлакова Е.Б., Храпова Н.Г. (1985). Успехи химии, 54, 1540-1558.
5. Бурлакова Е.Б., Алесенко А.В., Молочкина Е.М., Пальмина Н.П., Храпова Н.Г. (1975). Биоантиоксиданты в лучевом поражении и злокачественном росте. М.,Наука, 214.
6. Vladimirov Yu.A. Studies of Antioxidant Activity by Measuring Chemiluminescence kinetics. (1996). ?d. Paker L. N.Y., ISNA, 125-144.
7. Rice-Evans C.A., Diplock A.T. (1993). Free Radic. Biol. Med., 15, 77-96.
8. Ковалевский Е.И., Клебанов Г.И., Теселкин Ю.О. и др. (1987). Вестн. офтальмол., 103, 48-51.
9. Halliwell B., Gutteridge J.M.S., Cross C.E. (1992). J. Lab. Clin. Med., 119, 598-620.
10. Глушков Р.Г., Гуськова Т.А. (1998). Новые лекарственные препараты, 1, 9-31.
11. Суринова Б. Н., Карпова Н.А., Кумин Ю.С. (1995). Хим. фарм. ж., 3, 14-15.
12. Nikolaeva I.S., Peters V.V., Padeyskaya E.N. (1992). 8th Mediter. Congr. Chemother. (May 24-29, Athens). Abstr., 366.
13. Глушков Р.Г., Гуськова Т.А., Голиков П.П. и др. (1996). Хим. фарм. ж., 1, 3-5.
14. Васильева О.В., Любицкий О.Б., Клебанов Г.И., Владимиров Ю.А. (1998). Биол. мембр., 15, 177-183.
15. Folch J., Lees M., Stanley G. (1957). J. Biol.Chem., 226, 497.
16. Кейтс М. (1975). Техника липидологии, 322.
17. Bangham A.D., DeGier Y., Greville G.D. (1967). Chem. and Phys. Lipids., 1, 225-246.
Поступила 23.03.99.
ANTIOXIDANT PROPERTIES OF ARBIDOL AND ITS STRUCTURAL ANALOGUES
O.V. VASILJEVA, O.B. LYUBITSKY1, T.A. GUSKOVA2, R.G. GLUSHKOV2, O.S. MEDVEDEV, YU.A. VLADIMIROV1
MV Lomonosov Moscow State University, Faculty of Basic Medicine, bld A, room. 1029, Moscow, 119899, Russia
1Department of Biophysics, Russian State Medical University, Ostrovityanova ul. 1, Moscow, 117869, Russia
2Centre for Chemistry of Drugs, Zubovskaya str. 7, Moscow,119815, Russia
The effect of arbidol and its structural analogues on the process of lipid peroxidation in phospholipid liposomes induced by Fe2+ has been investigated. It was shown that the antioxidant efficacy of arbidol and its derivatives is lower than that of alfa-tocopherol by two or three times. It was suggested that the mechanism antioxidant action of the arbidol and its structural analogues consists of scavenging of lipid radicals rather than chelating of Fe2+.
Key words: lipid peroxidation, arbidol, antioxidants, chemiluminescence.
декабрь 99
medi.ru »» Периодика »» Вопросы медицинской химии »» № 4 '99